摘要
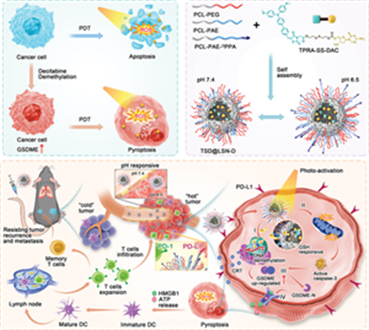
在肿瘤中诱导免疫原性细胞死亡 (ICD) 联合免疫检查点阻断 (ICB) 疗法被广泛开发,以提高癌症免疫疗法的疗效。然而,目前基于细胞凋亡诱导的ICD,即免疫原性细胞凋亡,由于细胞凋亡早期发生的炎症猝灭,其免疫原性往往受到限制。最近,细胞焦亡被证明是一种更有效的 ICD 形式,即免疫原性细胞焦亡。焦亡过程中释放的细胞内容物可以有力地激活肿瘤免疫原性。在此,首先,证明较低剂量的表观遗传药物地西他滨可以增加前列腺癌
(PCa) RM-1 细胞中的
GSDME 表达,并在光动力疗法
(PDT) 后成功诱导细胞凋亡-细胞焦亡转变。随后,开发了一种配备
PD-L1 阻断肽的微环境双响应纳米药物
(TSD@LSN-D),用于自协同癌症免疫治疗。免疫原性较差的RM-1
PCa模型证实,TSD@LSN-D诱发的强大抗肿瘤免疫反应不仅能有效抑制原发肿瘤,还能形成长期免疫记忆,防止PCa复发和转移。据作者所知,这项工作提出了第一个通过表观遗传调节促进肿瘤 PDT 后细胞凋亡-细胞焦亡转变的概念。此外,免疫原性细胞焦亡与 ICB 的强大结合为 PCa 免疫治疗开辟了一个新平台。免疫原性较差的RM-1
PCa模型证实,TSD@LSN-D诱发的强大抗肿瘤免疫反应不仅能有效抑制原发肿瘤,还能形成长期免疫记忆,防止PCa复发和转移。据作者所知,这项工作提出了第一个通过表观遗传调节促进肿瘤 PDT 后细胞凋亡-细胞焦亡转变的概念。此外,免疫原性细胞焦亡与 ICB 的强大结合为 PCa 免疫治疗开辟了一个新平台。免疫原性较差的RM-1
PCa模型证实,TSD@LSN-D诱发的强大抗肿瘤免疫反应不仅能有效抑制原发肿瘤,还能形成长期免疫记忆,防止PCa复发和转移。据作者所知,这项工作提出了第一个通过表观遗传调节促进肿瘤 PDT 后细胞凋亡-细胞焦亡转变的概念。此外,免疫原性细胞焦亡与 ICB 的强大结合为 PCa 免疫治疗开辟了一个新平台。
 津公网安备 12010402001780号
津公网安备 12010402001780号








